En vista de un mercado en pleno crecimiento y los avances legislativos en los últimos años, la industria del Cannabis Medicinal se abre paso en Europa. Cada vez son más los países europeos que anuncian el comienzo de la distribución de cannabis medicinal a pacientes en sus territorios, así como planes para la producción en base a requisitos regulatorios cada vez más clarificados. Es por ello que, diferentes empresas del sector farmacéutico comienzan a interesarse en la producción y/o fabricación de productos cannábicos con fines médicos y científicos, así como también lo hacen, muchas otras que, tradicionalmente han estado trabajado en el cultivo de cáñamo con fines industriales; pues se espera un crecimiento exponencial del tamaño de mercado de cannabis medicinal en Europa durante los próximos 4-5 años, llegando a valores estimativos de alrededor de 2,7 billones de €.
Los potenciales fabricantes de productos farmacéuticos a base de cannabis a menudo desconocen los requisitos reglamentarios que han de aplicar, y surgen numerosas dudas acerca de cuándo aplicar una normativa u otra en función del uso que se le pretende dar a la planta y/o producto final a ser fabricado.
El Comité sobre Productos Medicinales a Base de Hierbas (Comitee on Herbal Medicinal Products, HMPC) de la Agencia Europea del Medicamento (EMA) emitió la “Guideline on Good Agricultural and Collection Practice (GACP) for starting materials of herbal origin” especificando las directrices establecidas en la fabricación de medicamentos a base de plantas en aquellos pasos iniciales que tengan lugar sobre el terreno y en etapas de procesamiento post cosecha. El cometido principal de la emisión de esta guía es su aplicabilidad a todos los métodos de producción llevados a cabo en la fabricación de materiales de partida de origen herbáceo que sean incorporados, de manera estructuralmente significativa, en la composición de principios activos y/o medicamentos a base de cannabis.
Aunque, en la actualidad, a aquellos fabricantes de productos farmacéuticos a base de cannabis, que posean una única parcela en la cual cuenten con instalaciones tanto para el cultivo como para el procesado post cosecha GMP de la planta de cannabis, dando lugar a un principio activo y/o medicamento como producto final, no se les exija estar en posesión de una certificación de buenas prácticas agrícolas (GACP) para el cultivo en Europa; estas disposiciones han de tenerse en cuenta, de manera conjunta, con las directrices EU GMP para la fabricación de medicamentos a base de plantas.
En el anexo 7 de la Normativa GMP, dedicado a la Fabricación de Medicamentos a base de plantas, se dispone que la aplicabilidad de esta normativa en la fabricación de medicamentos a base de plantas comienza a partir de los pasos de corte y secado del material herbáceo. Sin embargo, la aplicación de la normativa GMP en la fabricación de productos farmacéuticos a base de cannabis no siempre es tan evidente e intuitiva, como se ha descrito anteriormente, en base a la norma. Tanto es así, que de acuerdo con la Tabla 1 de la Parte II de las EU GMP, dedicada a la fabricación de sustancias activas usadas como materiales de partida, se especifica que, para la fabricación de un extracto vegetal de calidad API farmacéutico (en este caso en particular se considera la fabricación de un extracto cannábico de calidad API farmacéutico), se han de considerar particularmente los objetivos aislados de cada una de las etapas de extracción que se lleven a cabo en la fabricación de productos farmacéuticos a base de cannabis. Por lo que, no se hace necesaria la aplicación de la normativa GMP en aquellas extracciones iniciales que se realizan en compuestos cannábicos, y que dan lugar a materias primas con alto contenido en impurezas, siendo necesaria la realización de un análisis de la gestión del riesgo para la identificación de los puntos críticos de calidad en los procesos de producción, en base al que se justificará la aplicación de la normativa GMP en las etapas de purificación y concentración de cannabinoides posteriores que dan lugar a un producto farmacéutico.
La guía de definición para la aplicación de la normativa GMP en la fabricación de productos farmacéuticos a base de cannabis consiste, además del seguimiento de las directrices establecidas por normativa, en la realización integrada de 3 puntos fundamentales:
- Definición de la tipología de producto a base de cannabis medicinal a fabricarse y comercializarse. Si se trata de un producto terminado o de un principio activo, y dentro de estas dos variantes si es obtenido a partir de molienda y secado de la planta y/o procesos de extracción y purificación. El titular de la autorización de comercialización (MA) asume la responsabilidad plena de la categorización del producto farmacéutico a comercializarse.
- Definición de métodos de producción específicos. Su definición es la premisa para la Gestión de Riesgos de la Calidad (QRM, Quality Risk Management), identificándose los puntos críticos de la producción donde la normativa GMP ha de aplicarse directamente.
- Identificación de los puntos críticos de calidad. El nivel de exigencia de aplicación de la normativa GMP en la fabricación de principios activos a base de cannabis, se incrementará a medida que el proceso de producción sea desarrollado hacia las etapas finales de purificación y envasado de productos farmacéuticos a base de cannabis.
Por otro lado, otro punto de partida fundamental a tener en cuenta desde el punto de vista de Gestión Integral de Proyectos de Cannabis Medicinal, enfocado al SCF (Sistema de Calidad Farmacéutico) es acerca de la etapa del proyecto en la que se ha de comenzar el desarrollo del SCF.
El desarrollo e implementación del Sistema de Calidad Farmacéutico GACP&GMP comienza tras el diseño y adecuación de las instalaciones y tipologías de productos a fabricar de acuerdo con los requisitos regulatorios, finalizando el mismo con la obtención de la Certificación EU GMP.
Las etapas involucradas en el desarrollo y puesta en marcha de las instalaciones para el procesamiento de la Cannabis sativa L. con fines médicos y científicos, en nuestro país, quedan resumidas como sigue:
- Diseño del proyecto y adecuación para el cumplimiento de los requisitos regulatorios
- Comienzo del desarrollo e implementación del SCF GACP&GMP
- Solicitud a la Agencia Regulatoria de una Asesoría Técnica. Esta fase consiste en la redacción de un dossier completo, de estructura similar a la memoria técnica, presentada a la Agencia Regulatoria para la solicitud para la solicitud de autorización del cultivo de los lotes necesarios para la validación del proceso. La respuesta de esta asesoría permite a la entidad interesada ‘asegurar’ la conformidad de la Agencia Reguladora con el proyecto a desarrollar, tratándose de una respuesta no vinculante.
- Construcción de la instalación
- Solicitud de Autorización de cultivo de lotes necesarios para la validación del proceso.
- Finalización del desarrollo e implementación del SCF GACP&GMP.
- Inspección final y Certificación EU GMP para el cultivo, producción, fabricación y distribución de productos farmacéuticos a base de Cannabis sativa L.
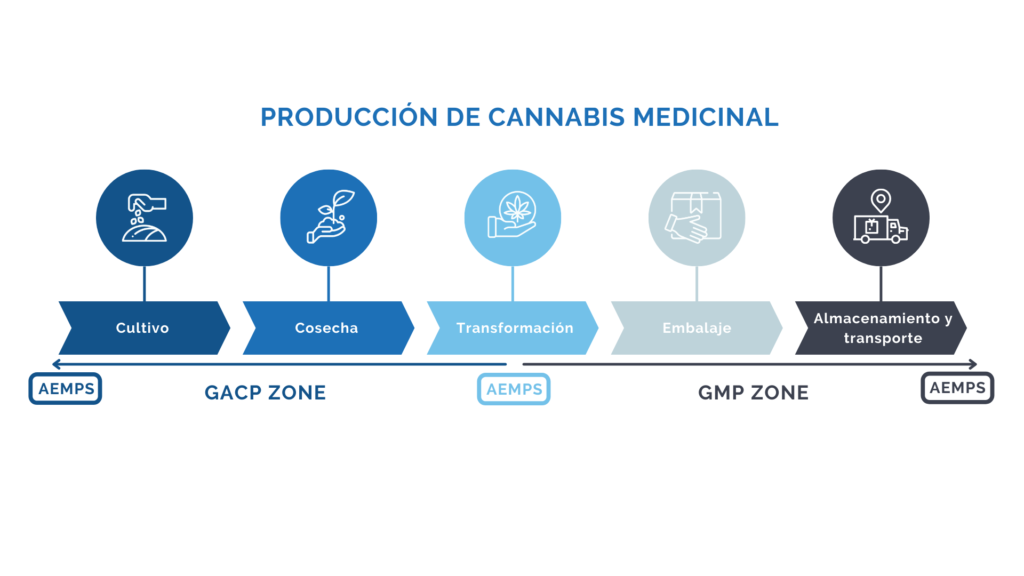
Figura 1: Producción de cannabis medicinal
Un laboratorio de fabricación de productos cannábicos farmacéuticos, el cual se encuentra involucrado en el proceso desde el cultivo de la Cannabis sativa L. es sujeto de inspección por parte de la AEMPS desde el momento de la solicitud para la obtención de la autorización de cultivo de los lotes necesarios para la validación del proceso. Esta etapa del proyecto se trata de una fase crítica del desarrollo de éste, pues se trata de un punto en el que el nivel de inversión es lo suficientemente alto como para no arriesgarse a una respuesta negativa por parte de la AEMPS, bloqueándose el proyecto hasta la corrección de todas las desviaciones críticas que hayan sido detectadas. En este punto del proyecto se han debido tener en cuenta todas las consideraciones descritas por la normativa GACP para la implementación de un SCF robusto en las instalaciones de cultivo de Cannabis sativa L., y el SCF se ha de encontrar desarrollado e implementado al 60% con respecto a la finalización del proyecto y puesta en marcha.
El desarrollo de un proyecto para la fabricación de un producto farmacéutico a base de Cannabis sativa L. cuenta con la particularidad de que, se ha de obtener una autorización de cultivo de los lotes necesarios para la validación del proceso, previamente a la inspección final por parte de la Agencia Reguladora para la consecución de la Certificación EU GMP.
Además de los procedimientos básicos del sistema de calidad, es necesario atender al cumplimiento, desde el punto de vista de SCF, de los siguientes puntos clave para la obtención de la autorización de cultivo de los lotes necesarios para la validación del proceso:
Gestión y Contabilidad de Estupefacientes
Se ha de garantizar el registro correcto de todos los movimientos de sustancias con contenido en estupefacientes durante todo el periodo de tiempo en el que una entidad posee una autorización para cultivo, fabricación, producción y/o distribución de productos farmacéuticos a base de Cannabis sativa L.
Su implementación en el SCF es fundamental y obligatoria para la consecución de la licencia correspondiente; debiendo ser esta parte del SCF implementada dentro del Aseguramiento de la Calidad de la planta de producción. Para su implementación se ha de tener en cuenta, fundamentalmente, las bases establecidas en la legislación aplicable en nuestro país.
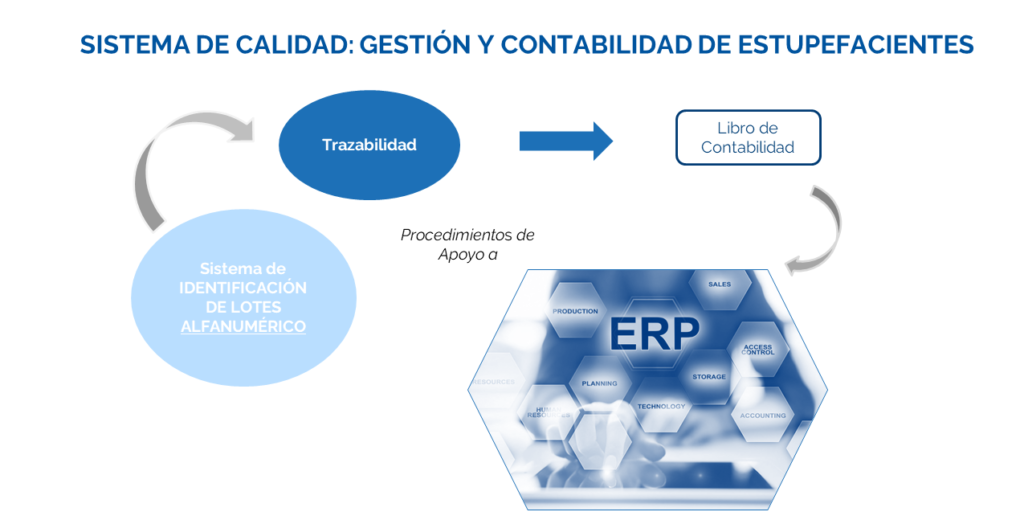
La Gestión y Contabilidad de Estupefacientes para la fabricación de productos cannábicos farmacéuticos, debe permitir e integrar lo siguiente:
- Posibilidad de realización de un ejercicio de trazabilidad hacia adelante y hacia atrás.
- Establecimiento de registros para la Contabilidad de Estupefacientes, trazables entre ellos.
- Realizar la trazabilidad inequívoca a las fuentes de procedencia (planta madre → clon/esqueje → semillas)
En la actualidad, la manera de implementación más sencilla de un sistema de gestión/contabilidad de estupefacientes en una empresa farmacéutica es mediante la implementación de un software de gestión de procesos de negocios que incluyen módulos para la automatización de las funciones trazabilidad en la producción. Se trata de sistemas computarizados que deberán ser validados previo a su utilización para llevar a cabo la verificación de su cumplimiento con los principios de Integridad de Datos.
Figura 2: Sistema de Calidad. Gestión y contabilidad de estupefacientes
DESTRUCCIÓN DE RESIDUOS
Además de asegurar la correcta destrucción de aquellos productos que no reúnan los requisitos de calidad necesarios para ser distribuidos (productos devueltos, caducidades, desechos, APIs no conformes, etc); se hace necesaria la correcta gestión y destrucción de todos aquellos residuos de Cannabis sativa L. de acuerdo con la legislación en vigor. En este sentido, es necesario:
- Mantener un control sobre los productos destinados a destrucción con el fin de darles un tratamiento administrativo.
- Emisión de Certificados de destrucción incluyendo la cantidad destinada a destrucción.
- Asegurar que las situaciones, física e informatizada, de los productos destinados a destrucción correspondan en todo momento con las instrucciones emitidas por parte del responsable de Calidad.
- La destrucción de residuos ha de llevarse a cabo por un gestor de residuos autorizado/homologado para tal fin.
PLAN MAESTRO DE SEGURIDAD EN LAS INSTALACIONES
El proyecto de Seguridad a implementar en las instalaciones ha de cumplir como mínimo:
- Establecimiento de procedimientos específicos de entrada/salida del personal, para el registro de acceso, indicando que se ha de impedir el acceso a la parcela de personal ajeno o como mínimo retrasar la intrusión.
- Sistemas de Videovigilancia integrados
- Definición de una serie de Acciones Correctivas/Preventivas Establecimiento de PNT específico de Gestión de Robos/Pérdidas.
- Bunkerización de la cosecha para impedir su robo en caso de intrusión
CONCLUSIÓN
En conclusión, es necesario implementar y considerar ambas normativas GACP&GMP para el establecimiento de un Sistema de Calidad Farmacéutico adecuado que evite los errores intrínsecos y/o derivados de la alta variabilidad existente en la producción de medicamentos y/o principios activos a base de cannabis, asegurando la calidad del producto final a obtener desde las primeras etapas que tienen lugar sobre el terreno. Además, este SCF ha de ser desarrollado durante todas y cada una de las etapas del proyecto, y que permita superar con éxito las inspecciones de las Agencias Regulatorias, ya sea bien la obtención de la autorización para el cultivo de cannabis de los lotes necesarios para la validación del proceso, como para la obtención de la Certificación EU GMP para fabricación.