Las Normas de Correcta Fabricación (GMPs) nos indican que debemos tener un sistema de gestión de desviaciones y/no conformidades robusto y eficaz dentro del Sistema de Calidad Farmacéutico.
En ocasiones nos puede parecer una tarea difícil, pesada y que ocupa mucho tiempo. Sin embargo, el tiempo invertido en desviaciones no es tiempo perdido sino que supone una oportunidad tanto para detectar problemas y poner medios para evitarlos, como para conocer y mejorar nuestra empresa.
En este blog aportamos algunas propuestas e ideas para conseguir una gestión eficaz y cambiar la percepción negativa que se tiene de las desviaciones.
El primer consejo es comprender que las desviaciones van a estar presentes y ser conscientes. Debemos asimilarlo ya que otra realidad no es posible, porque ocultar un problema no lo va a hacer desaparecer, y no está permitido. Siempre se dará alguna que otra desviación y lo importante es detectarlas para evitar su recurrencia y acumulación. No podemos concebir la idea de no tener ninguna desviación, ya que generaría desconfianza.
Se debe tener en cuenta que para una gestión eficaz de las desviaciones, todo el personal afectado en la planta farmacéutica debe implicarse en la detección y resolución de desviaciones. Es una tarea habitualmente coordinada y gestionada por Garantía de Calidad, pero necesita la colaboración de los departamentos involucrados para llegar al objetivo de encontrar la causa raíz y poder atacarla.
Es necesaria una buena formación de todo el personal para asegurar tanto una buena comunicación de las desviaciones detectadas como un correcto registro. El que sabe o puede saber lo que ha pasado es quien está en todo el proceso y es el que dispone de toda la información real, que puede aportar a la investigación de la desviación. No obstante, es esencial el trabajo en equipo para aportar toda la información relevante que se dispone y conseguir buenos resultados, sin buscar culpables sino buscar causas y oportunidades de mejora.
Otro punto importante a considerar es que en la industria farmacéutica podemos encontrar desviaciones a lo largo de todo el proyecto: almacenes, producción, control de calidad, sistema de calidad, etc.
Se considera desviación a todo aquel alejamiento de un procedimiento escrito, como por ejemplo incumplimiento de PNTs, de instrucciones de fabricación, acondicionamiento, analíticas, en programas de mantenimiento, cualificación, calibración validación, en funcionamiento de instalaciones y equipos, de procesos, compromisos de autorización, resultados analíticos, auditorías…
La clave está en esta pregunta: «¿Debemos tratarlas a todas por igual?»
En el capítulo 1 de las Normas de Correcta Fabricación (GMP) se indica “Cualquier desviación significativa ha de quedar totalmente registrada y debe ser investigada, con el objetivo de determinar la causa raíz, e implantar las acciones correctoras y preventivas adecuadas”.
Entonces, ¿debemos registrar solo las significativas? No, debemos registrar todas las desviaciones que se produzcan en nuestra planta, pero quizás no necesitan de un informe formal y completo de investigación, ya que dependerá de su grado de significancia.
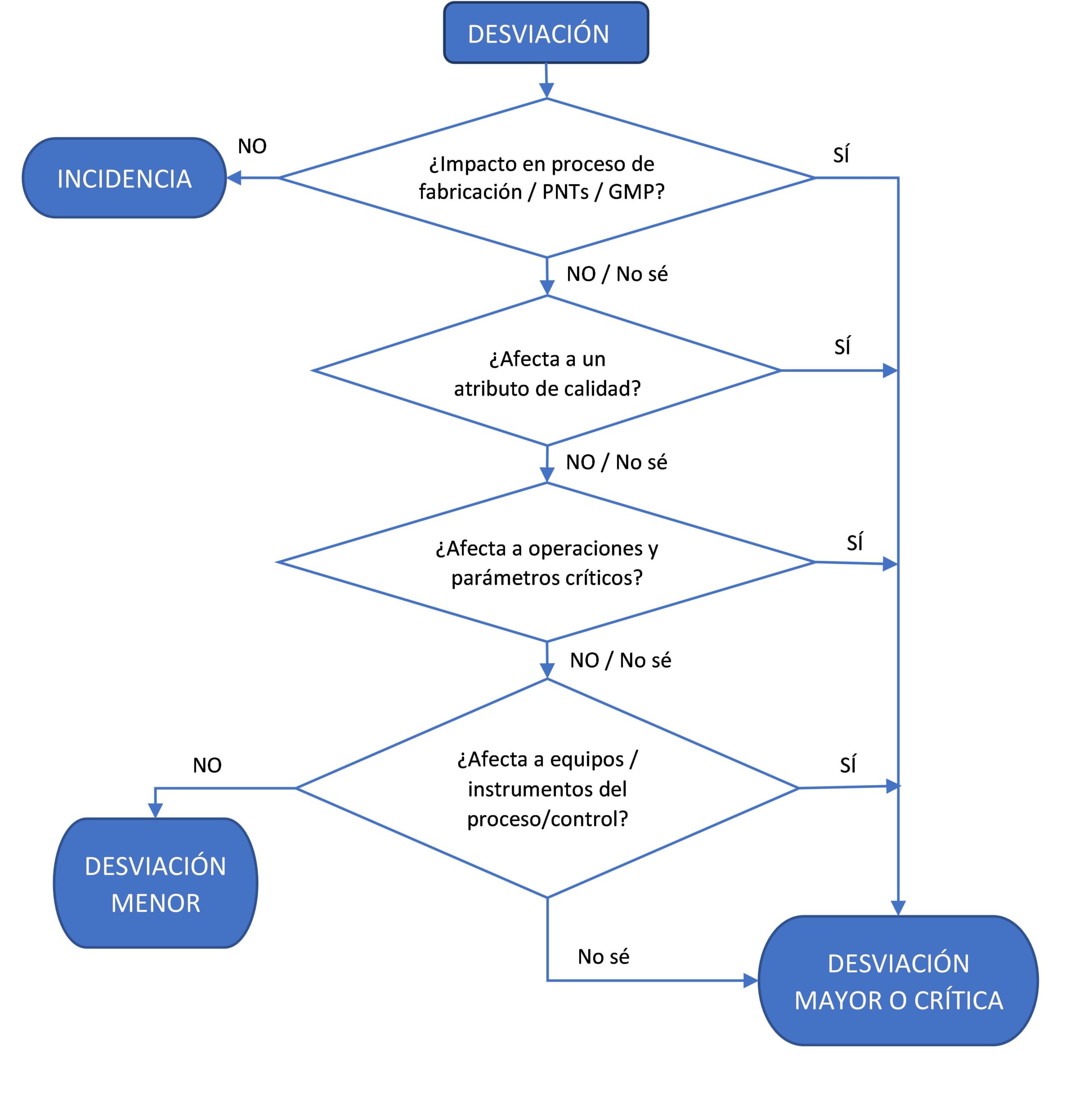
¿Qué podemos considerar desviaciones significativas? Son todas aquellas desviaciones que pueden afectar directa o indirectamente a la calidad, seguridad o eficacia del producto y/o que implican incumplimiento de algún requerimiento GMP o en la autorización de comercialización.
Esto nos conduce a otro reto: clasificar la desviación según su criticidad. Normalmente clasificamos las desviaciones en críticas, mayores, menores o incidencias considerando su impacto en el producto, en asuntos regulatorios y/o en normativa GMP. En ciertos casos aplicamos el sentido común, lo cual es muy subjetivo, pero se requiere de bastante experiencia y habilidad a la hora de clasificar una desviación según su importancia. Actualmente se espera que la clasificación de las desviaciones se realice utilizando el enfoque de gestión del riesgo.
El enfoque de gestión del riesgo es una herramienta muy útil que, implantándola en nuestro procedimiento de desviaciones, permite sistematizar esta clasificación y evitar preguntas y dudas al respecto.
Una vez clasificada la desviación debemos considerar qué hacer en cada caso. El enfoque de gestión del riesgo nos permite poder seguir diferentes tratamientos según la criticidad de la desviación y así lo hemos de indicar en nuestro procedimiento de desviaciones. A continuación detallamos un posible tratamiento que podemos dar a las desviaciones con un buen sistema de gestión:
- Registro. En todos los casos debemos registrar la desviación en la documentación como que se ha producido. Esto nos permite disponer de un registro para evaluar la recurrencia y poder clasificarla.
- Justificación. En caso de incidencias podríamos añadir una justificación en la documentación en la que hemos registrado o realizarlo de una manera formal no siendo necesaria una investigación completa. En esta situación es altamente recomendable revisar la justificación por un responsable del proceso para dar la conformidad.
- Informe de desviación. Para todas aquellas desviaciones clasificadas como menores, mayores o críticas. Este informe de desviación debe indicar como mínimo la descripción, evaluación del impacto y clasificación, corrección realizada y CAPAs propuestas, propuestas y conclusión.
- Investigación de análisis de causa raíz. Para todas aquellas desviaciones clasificadas como mayores o críticas, es decir, en todas aquellas que se consideran «significativas». Como vemos en el diagrama, son aquellas que pueden afectar directa o indirectamente a la calidad, seguridad o eficacia del producto y/o que implican incumplimiento de algún requerimiento GMP o en la autorización de comercialización. Esta investigación debe incluirse en el informe de desviación.
¿Quieres ser eficaz y no morir en el intento?
En Qualipharma podemos ayudarte tanto en la implantación, mejora y optimización de la gestión de desviaciones como en formaciones específicas y a medida sobre este punto clave de las GMPs


1 comentarios
JORGELINA CASTILLO
Los artículos son muy interesante y claro.