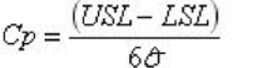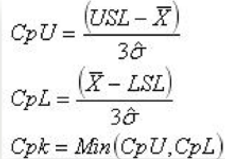En los laboratorios farmacéuticos nos encontramos documentos con una relevancia especial que son conocidos, en mayor o menor medida, por todos los integrantes del sector por tener una participación indispensable dentro del sistema de calidad farmacéutico.
Uno de estos documentos esenciales es la revisión de la calidad del producto o mejor conocido por sus siglas en ingles PQR (Product Quality Review). Este PQR aparece como necesario en el primer capítulo de las GMP donde se nos establece aquellos apartados mínimos que debe contener y qué objetivos queremos alcanzar. Citando textualmente la normativa (apartado 1.10 de la parte I de la GMP) su principal objetivo es:
“verificar la consistencia del proceso existente, la pertinencia de las especificaciones en curso tanto de materiales de partida como de producto terminado, para destacar cualquier tendencia, y para identificar mejoras de proceso y de producto”
En definitiva, saber si nuestro tándem producto/proceso sigue manteniendo unas características correctas para la fabricación (estado de control) y si podemos detectar mejoras a implementar en el mismo. Esto se consigue revisando todo aquello que puede afectar a nuestro producto/proceso: materiales de partida, lotes no conformes, desviaciones, controles de cambios, variaciones en la autorización de comercialización, estabilidades en curso, devoluciones, CAPAs o estado de cualificación de equipos y servicios.
Además, para el estudio objetivo del estado de control de nuestro proceso, tendremos que revisar un factor más: los resultados de los controles en proceso críticos y de producto terminado. La revisión y estudio de estos resultados nos permitirán saber si nuestro proceso está bajo control y, no menos importante, si podemos mejorarlo.
¿Proceso bajo control?
Llegados a este punto, la pregunta que aparece es: ¿Cómo estudiamos los resultados? ¿Qué quiere decir que nuestro proceso está bajo control? Para responder a estas preguntas se han utilizado diferentes estrategias, desde gráficos simples o tablas de datos para detectar tendencias “a ojo” a estudios con softwares estadísticos para calcular una serie de índices y parámetros más complejos. El problema real radica en que no tenemos una definición clara de “estado de control” en la normativa y a lo largo de los años se ha tenido que ir definiendo con diferentes criterios estadísticos. Como ejemplo de esta adaptación y mejora expondremos datos de las diferentes observaciones detectadas en auditorias FDA en relación con el APQR (Annual Product Quality Review), análogo del PQR en Estados Unidos.
En 2018 se detectaron 28 observaciones relacionadas con la revisión de calidad del producto y 16 concretas sobre el número de lotes utilizado para hacer el estudio (síntoma de uso no del todo correcto de las herramientas estadísticas), en 2019 estas cifras se redujeron a 29 y 9, en 2020 estas cifras fueron de 12 y 2 para finalmente ser en 2021 6 afectaciones generales en la revisión de calidad del producto y 1 en el número de lotes utilizados. Por tanto, vemos una tendencia a mejorar, pero aun con algunas deficiencias en este nivel. A nivel europeo no tenemos una fuente tan clara de esta información, pero podemos suponer que la tendencia sea la misma.
Esta mejora, como hemos apuntado anteriormente, se puede deber a una mejor definición de estado de control y a las pruebas a realizar para determinarlo. En términos estadísticos, según diferentes expertos en la materia, podremos hablar de proceso bajo control cuanto este sea estable y capaz.
Hablemos de estabilidad y capacidad
Como en la sección anterior tenemos que plantearnos la siguiente pregunta: ¿cómo determinamos la estabilidad y capacidad de un proceso? Es aquí donde empezaremos a necesitar de herramientas estadísticas para estudiar los atributos críticos de calidad de nuestro producto (CQA del inglés Critical Quality Attributes). Estos CQA dependerán de cada producto, pero para contextualizar con ejemplos, podríamos hablar de volúmenes de producto final, peso de comprimidos, pH de una solución, ensayos de contenido, carga microbiana del producto o, en definitiva, de todos aquellos parámetros con unas especificaciones que se deben cumplir para que nuestro producto tenga la calidad correcta. La suma de los resultados de estabilidad y capacidad para cada uno de estos CQA nos dará información del estado global de nuestro proceso y, además, de en qué fases o etapas podemos mejorar (o como mínimo si hay posibilidad de mejora).
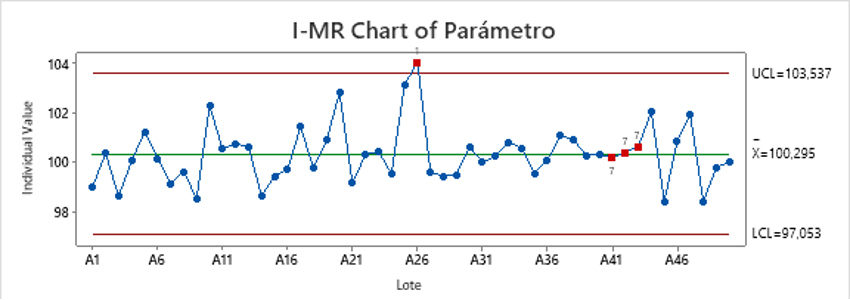
Para determinar la estabilidad de un proceso hay diferentes métodos más o menos complejos, pero una aproximación que nos aporta suficiente información es la utilización de gráficos de Shewhart (Control Charts) y las reglas de Nelson que los complementan ya que gráficamente tenemos esta información de manera simple pero completa. Estos nos dan una idea precisa de la estabilidad global de nuestro proceso durante el periodo estudiado y nos permiten detectar eventos puntuales que pueden estar relacionados con problemas específicos en esta estabilidad. Veamos un ejemplo:
Ilustración 1. Ejemplo Gráfico de Shewhart con valoración de reglas de nelson para estudio estabilidad (Fuente Minitab)
En el gráfico observamos valores de un parámetro con especificaciones de 95 a 105, en el que todos los valores y límites de control están dentro de especificaciones. Esta situación, que nos haría pensar en una estabilidad global correcta para nuestro parámetro se complementa con algunos valores (marcados en rojo) que son positivos en alguna regla de Nelson. Estas reglas o pruebas detectan si se han producido situaciones en nuestros datos que, por su baja probabilidad de ocurrir de forma aleatoria, indican un posible punto de inestabilidad.
Si entramos un poco más en detalle, en nuestros datos encontramos un punto que supera 3 veces nuestra desviación estándar (positivo para la prueba de Nelson 1) y tres puntos después de tener 15 valores dentro de 1 desviación estándar de la media (positivo para la prueba de Nelson 7). ¿Quizás ha pasado alguna cosa en el lote A26? ¿Podemos detectarla y relacionarla con un resultado peor que los otros? ¿Ha ocurrido alguna modificación en el proceso a partir del lote A27 para que los resultados tengan valores muy parecidos durante tantos lotes? Y, al contrario, ¿ha pasado alguna cosa en nuestro proceso para que a partir del lote A44 los resultados volviesen a tener valores diferentes?
Los resultados nos permiten estudiar estos hechos y son útiles para detectar cambios en nuestro proceso antes de tener resultados fuera de límite establecidos para así poder tomar las medidas adecuadas para que sigamos teniendo una buena estabilidad del proceso.
Para determinar la capacidad de un proceso, tendremos que utilizar los índices Cp y Cpk. ¿Que son estos índices y que nos dicen? Los cálculos de estos índices relacionan los límites de nuestra especificación con la desviación de nuestros valores (fórmulas en la ilustración 2). Más allá del como calcularlos (si tenemos algún software no nos tendremos que preocupar), lo realmente importante es saber que significan y como interpretar sus resultados.
Ilustración 2 Fórmulas para el cálculo de Cp y Cpk
El índice Cp nos indica si la variabilidad de nuestro proceso permite que este esté dentro de especificaciones. El índice Cpk nos indica cómo de centrado está nuestro proceso respecto a estas especificaciones (por eso hay dos valores iniciales, CpU y CpL, al estudiarse lo cercano o alejado que están los valores de los dos límites de especificación). Los valores que deben tener estos índices para ser aceptables en nuestra industria son > 1.
Un ejemplo para visualizar estos índices sería imaginarnos una portería y una pelota. En este ejemplo, los palos de la portería serían nuestros límites de especificación y la pelota los diferentes resultados obtenidos. Veamos las diferentes situaciones:
- Valores de Cp menores a 1: Aquí la pelota es tan grande que no cabe en la portería o traducido a un proceso farmacéutico, la dispersión de los resultados hace que no se pueda asegurar que se mantengan dentro de límites por sus propias características. En esta situación ya no nos plantearemos el estudio de Cpk y tendremos que mejorar primero el proceso.
- Valores de Cp mayores a 1 y valores de Cpk menores a 1: aquí la pelota puede entrar en la portería sin problemas, pero en ocasiones se desvía y fallamos el tiro. Traducido a un proceso farmacéutico nuestro proceso es capaz pero los resultados están desviados hacia uno de los límites de especificación y tendremos que tomar las medidas adecuadas para centrar estos resultados.
- Valores de Cp y Cpk mayores a 1: aquí la pelota puede entrar y tenemos la puntería suficiente para que entre centrada. Traducido a un proceso farmacéutico sería la situación de capacidad que queremos alcanzar.
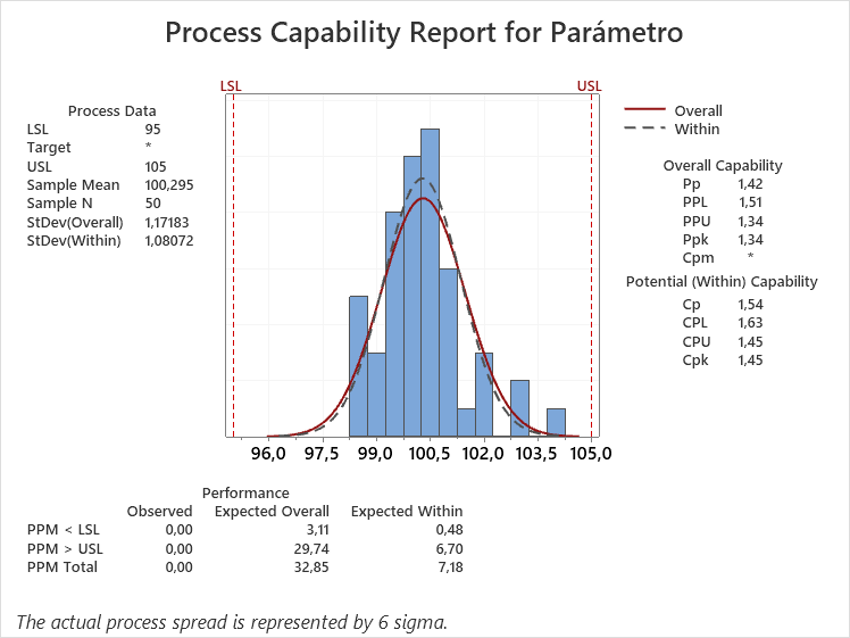
En la ilustración 3 vemos el resultado del estudio de capacidad de los valores del ejemplo anterior. En este caso, tenemos unos valores de Cp y Cpk mayores que 1 por lo que nos encontramos delante de un proceso capaz y centrado en las especificaciones. En el caso concreto del software utilizado (Minitab) también nos proporciona valores esperados de resultados fuera de especificaciones, relacionado con la centralidad de los datos. En el ejemplo vemos que aproximadamente 33 lotes de cada millón tendrían algún resultado fuera de especificaciones, reforzando los buenos resultados de capacidad del parámetro.
Ilustración 3 Ejemplo estudio capacidad (Fuente Minitab)
Los estudios de estabilidad y capacidad que hemos observado deberán ser acompañados como mínimo de alguna comprobación previa como el estudio de distribución de los datos y determinación de valores aberrantes para asegurarnos que estamos aplicando las herramientas estadísticas de forma correcta y la información obtenida se corresponde con la realidad. No olvidemos que hay una situación más peligrosa que no aplicar estudios estadísticos: ¡realizar estudios de forma incorrecta que nos lleven a conclusiones no reales!
Estudiando los números del PQR con ayuda
Como conclusión, podemos decir que la correcta utilización de estas herramientas estadísticas y todos los valores e índices que nos dan, nos permitirán sacar partido a todos los “números” que tenemos de nuestro proceso y llegar al verdadero objetivo del PQR: mejorar nuestro proceso para seguir produciendo un producto con las características de calidad adecuadas. Citando al físico Mario Bunge: “La información en sí misma no vale nada, hay que descifrarla”.
Mantén tus procesos controlados
Realizamos estudios estadísticos y te ayudamos a interpretar esta información para que los PQR sean los más completos y útiles posibles, permitiendo tener los procesos controlados.