Una vez el concepto de integridad de los datos es algo ya común en nuestro día a día; y que muchas compañías ya han completado un proceso de evaluación general de sus procesos frente a los elementos de la integridad de los datos; una de las áreas en las que más dificultades de evaluación, identificación de registros y gaps nos podemos encontrar, son nuestro equipos de producción. En este artículo se presenta una propuesta de cómo llevar a cabo esa evaluación, identificar los registros y establecer su criticidad, qué acciones tomar no solo para mantener la integridad de esos registros sino también para establecer procesos de revisión que garanticen la continuidad del cumplimiento de los principios de integridad de los datos.
Estoy seguro de que prácticamente a nadie le es ajena, a día de hoy, la extrema importancia que tiene la integridad de los datos en la industria farmacéutica. Lo cierto es que las buenas prácticas documentales han conquistado, desde hace ya muchos años cada una de las actividades GMP de cualquier laboratorio.
Actualmente todos los trabajadores están entrenados sobre qué se debe registrar y cómo hacerlo. Del mismo modo, dichos registros son revisados, archivados, mantenidos y destruidos una vez se ha cumplido su tiempo de retención, pudiéndose consultar hasta entonces todos los procesos que se han ejecutado, las condiciones en las que lo fueron y las personas que participaron en tales acciones. ¿O puede que no sea cierto del todo?
Si bien la generación de documentación en papel, su custodia y consulta es común en nuestro día a día; y que muchas compañías ya han completado un proceso de evaluación general de sus procesos frente a los elementos de la integridad de los datos; una de las áreas en las que más dificultades de evaluación, identificación de registros y gaps nos podemos encontrar, son nuestros equipos de producción.
Estos equipos, actualmente, tienen un nivel de automatización de medio a elevado, con capacidades que en los nuevos modelos nos permiten un completo cumplimiento de los principios de integridad de datos en sistemas informatizados (GMP Anexo 11, 21CFR, etc.), pero que, al partir de una situación de sistemas más precarios y de menores exigencias en este aspecto, además de la dificultad inherente a la especificidad de los procesos que cada uno desarrolla; convierten su cumplimiento en un asunto complejo.
En todo momento hemos de tener presentes los principios ALCOA+ para los registros que nuestros equipos generen: atribuibles, legibles, contemporáneos a la actividad, originales, precisos, completos, uniformes, duraderos y disponibles; todo ello con dos objetivos, asegurar la calidad de nuestras operaciones y aumentar la productividad que aporta la automatización de todas estas actividades.
El primero de los principios, conseguir unos registros atribuibles, quizás sea el más sencillo de alcanzar, el que más seguridad aporta y al mismo tiempo en el que más gaps solemos detectar. Para que los registros que genera nuestro equipo sean atribuibles es necesario que sea capaz de identificar al usuario que lo opera y que imputará una fecha y hora correctas a los registros. Es por ello que asegurar estos dos requisitos para todos nuestros equipos debe ser el punto de partida. Junto a ello debemos abordar otras cuestiones no menos importantes: ¿Controlamos el acceso de cada usuario (personal) a las funcionalidades que requiere? ¿Están suficientemente restringidas? ¿Estamos logrando impedir la suplantación? Con una adecuada gestión de accesos se puede asegurar, en la mayoría de los casos, una adecuada gestión de los registros críticos de cada equipo, aportando una alta seguridad y confianza en nuestros procesos.
El tener datos legibles durante todo el ciclo de vida de los mismos no es una cuestión baladí cuando se trata de datos informáticos. En muchas ocasiones tendremos que custodiar y consultar registros de procesos y pistas de Audit Trail durante años, aún habiendo retirado de uso el equipo/sistema que los generó. Actualmente no es extraño archivar datos sin haber asegurado un mecanismo de lectura de los mismos.
Un problema muy cercano a este es el de la disponibilidad y durabilidad de nuestros registros. Es habitual la pérdida de datos críticos que sí son almacenados en los registros de nuestros equipos, pero que nunca llegan a ser archivados. Son eliminados antes de completarse el tiempo de retención o son archivados de tal modo que su accesibilidad o recuperación es muy compleja, todo ello tiene como consecuencia una no disponibilidad para revisiones, inspecciones o auditorías. Todos estos aspectos deben formar parte del diseño original del ciclo de vida de nuestro equipo y en todo caso, debemos contemplarlo a posteriori para evitar estas pérdidas.
Por último, la generación de registros contemporáneos, originales, completos y uniformes debe ser verificada en la validación o cualificación de los equipos y sistemas, así como en el diseño de los flujos de trabajo con los mismos. A priori los sistemas informatizados dan una alta seguridad en estos cuatro puntos, pero no son extraños los casos en los que aparecen gaps o que ponen en riesgo la confianza en estos puntos: análisis que pueden ser eliminados de nuestro equipo, registros que no se guardan hasta finalizar un proceso (con el consiguiente riesgo de pérdida de información), parámetros que no son historizados, recetas modificadas indebidamente, etc.
Cada una de estas características deben ser evaluadas con el fin de asegurar, durante todo el ciclo de vida de los equipos, el mantenimiento del estado de validación y la seguridad, por lo que cualquier fallo deberá ser remediado mediante una adecuación del sistema o con medidas auxiliares, como registros externos, operativas seguras o el respaldo en otros puntos del proceso.
Para asegurar el mantenimiento de la calidad de los procesos proponemos un enfoque centrado en la evaluación de los registros y su criticidad para cada equipo:
En primer lugar, identificaremos los registros críticos: serán todos aquellos que soporten información que permita garantizar la calidad del proceso y la propia integridad de los datos. En el caso de haber descrito unos parámetros críticos de calidad en el equipo, los registros de sus medidas en el proceso, sus modificaciones en la configuración del equipo (recetas o parámetros claves de las mismas, selectores, etc.) configurarán los registros críticos, que probablemente estén contenidos en el Audit Trail y en Informes de Proceso u otros registros históricos. En aquellos casos donde no se haya realizado el ejercicio de describir parámetros críticos de calidad, como pueda ser en acondicionamiento, podremos tener también registros críticos, como pudiera ser el rango de aceptación de una pesadora dinámica para un determinado producto o lote.
Tendremos que tener en cuenta también los registros de prioridad media: aquellos que aseguran la calidad del proceso y la propia de integridad de los datos de un modo indirecto. Un buen ejemplo será el Audit Trail de la gestión de usuarios, que asegurará que se han respetado los accesos, lo cual, a su vez, soportará que el personal que ha empleado el equipo se hallaba adecuadamente formado.
Todos estos registros deberán ser adecuadamente custodiados, pero también revisados y verificados, del mismo modo que las guías de fabricación son revisadas junto a informes generados por los propios equipos. La periodicidad y el tipo de estas revisiones podrá variar en función de la criticidad del dato buscado, como hemos visto previamente; pero también del riesgo existente en el equipo de que el uso del mismo escape al adecuado control.
De este modo, para un equipo típico de fabricación (con un sistema de control competente), que disponga de una operación mediante recetas, con un ciclo de aprobación adecuado en el propio sistema y con una imputación controlada de las mismas, así como de los usuarios del mismo; bastarán revisiones aleatorias de su Audit Trail dentro de un universo de auditorías internas o en base a procedimientos que establezcan esa periodicidad.
No obstante, un equipo en el que el usuario pueda manipular los parámetros durante el proceso, de una forma no controlada en el propio sistema, requerirá de un análisis más estricto; donde se valore el posible conflicto de interés del usuario, la posibilidad y efecto de la manipulación de dichos parámetros y la capacidad de detección de daño en el producto si se produjera. En ocasiones, si no hemos configurado adecuadamente nuestro equipo o diseñado un proceso seguro; serán necesarias revisiones rutinarias o periódicas de los registros.
Será, por tanto, prioritario; realizar una adecuada identificación de los registros críticos en aquellos equipos en los que habitualmente estos conceptos se elaboran menos, como pueden ser equipos de acondicionamiento o auxiliares y re-evaluar sistemas, equipos de fabricación y laboratorio, teniendo en cuenta que todo dato (y los metadatos asociados) que nos permitan asegurar la calidad de las operaciones realizadas en los mismos, deben ser custodiados y revisados.
Llegados a este punto, es necesario recapitular sobre las acciones básicas a emprender para lograr en nuestra organización un pleno cumplimiento de la integridad de datos en equipos de producción, partiendo de una situación de gestión no estandarizada o continuada de este aspecto. Se ha de tener en cuenta que completarlas, dependiendo de los recursos que tengamos y del volumen de trabajo, posiblemente sea cuestión de años hasta alcanzar el objetivo. Nuestra recomendación es plantear las siguientes grandes fases y comenzarlas en este orden estricto, aunque su cierre se vaya superponiendo en el tiempo:
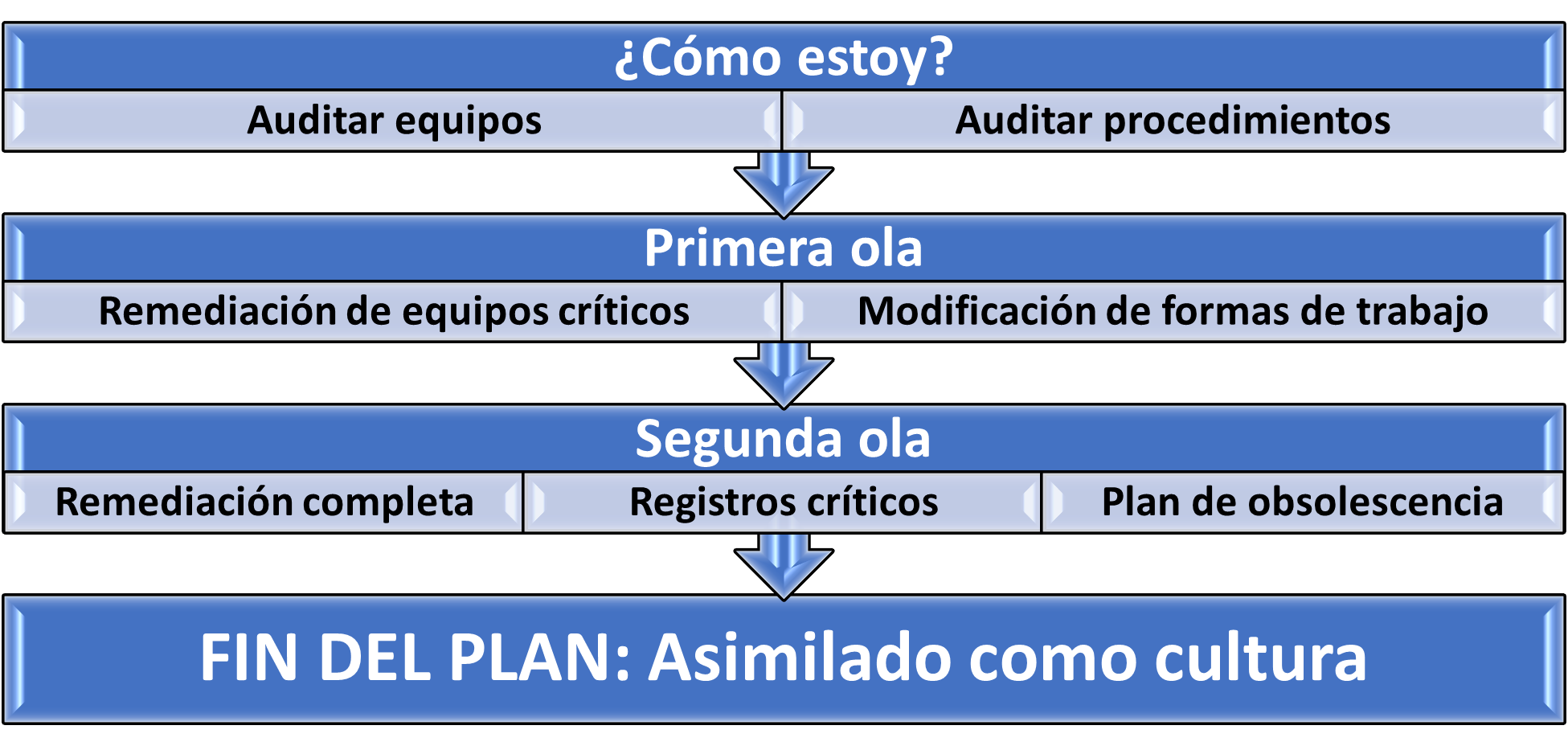
Analicemos, como ejemplo, un caso sencillo pero real para ejemplificar esta metodología: una balanza dinámica en una línea de estuchado de blísteres. Primeramente, analizaremos todos los elementos relacionados con ALCOA+, descubriendo en la inspección (auditoría inicial), entre otros; los siguientes fallos:
- Usuarios genéricos
- Permisos no congruentes con responsabilidades
- Registros de operación con fechas no verosímiles
- Registros de modificaciones de artículos no aprobados
- Funcionalidades críticas no validadas
- Registros superiores a 2 años no disponibles y no respaldados en copias
A continuación, se analizan los registros críticos del equipo, determinando que los datos que respaldan la calidad del producto están contenidos en el Audit Trail del sistema. Dichos parámetros en este caso serían aquellos que fijan los pesos de aceptación y rechazo para cada unidad pesada.
Por último, se deben mitigar los defectos encontrados en base al conocimiento adquirido sobre los registros críticos del equipo. En este caso se optó por una actualización del software del equipo que permitió el empleo de usuarios personales del dominio, una automatización de generación de back-ups de los archivos críticos y una actualización procedimental que incluye una revisión rutinaria de Audit Trail al final de lote para asegurar la configuración empleada en toda la orden. Evidentemente, fue preciso también validar aquellas funcionalidades no validadas previamente y las recientemente implementadas.
Estas remediaciones, en su conjunto, convierten estas pesadoras en un control robusto de la presencia de componentes para el 100% de los productos analizados, con una integridad de datos sin fisuras conseguida con tres de las soluciones más básicas, pero más potentes:
- Empleo de usuarios de dominio: la extensión de esta práctica a nuestros equipos de producción y laboratorio unida a unos permisos bien estudiados, controlados y revisados periódicamente evitan la capacidad de usuarios con posible conflicto de interés o sin preparación adecuada de intervenir en procesos que no les están permitido. De este modo eliminamos, por diseño, el riesgo de que se otorguen accesos no permitidos, se configure de forma no controlada el equipo o se modifiquen o eliminen registros. Al mismo tiempo, al trazar personalmente a los usuarios, se alcanza la identificación individual de cada acción (ATRIBUIBLE), les permite un uso sencillo de los mismos con contraseñas actualizadas globalmente y son controlados por el propietario del sistema desde el directorio activo, lo que supone un mantenimiento sencillo. La integración en el dominio de la planta generó otro beneficio, la sincronización del reloj del sistema, suprimiendo una actividad previa de mantenimiento y logrando un time-stamp indubitable.
- Automatización de back-ups: el archivado de los registros del equipo en un servidor fue posible gracias a la integración del equipo, aunque esto no siempre es posible para estos equipos supone una solución óptima. Una vez se dispone de estos archivos en una base de datos debidamente controlada se puede definir su método de acceso y la política de custodia de los mismos (DISPONIBILIDAD y DURABILIDAD). En estos casos no hay que olvidar que el nivel de protección de los archivos debe ser equivalente o más restrictivo que los originales.
Identifica los riesgos inherentes a la integridad de datos
Disponemos de la experiencia y conocimientos necesarios para facilitar un soporte global a compañías con diferentes líneas de negocio, localizaciones y distintos procesos.
Revisión de Audit Trail al finalizar el lote: aquí tenemos el motivo por el que necesitamos unos registros electrónicos ALCOA+. El Audit Trail y el resto de los registros electrónicos han de ser plenamente confiables, pues en muchos casos serán el testigo último de nuestro proceso. Hemos de preguntarnos siempre, para cada proceso; si estamos seguros de que se ha desarrollado de forma adecuada, el 100% del tiempo. En el caso de que esa respuesta esté en un sistema informatizado seremos afortunados, pues estará en nuestra mano conocerlo. En nuestra pesadora no fuimos capaces de asegurar, a priori, que la configuración empleada en cada orden fuera la correcta (peso de aceptación), de modo que fue preciso mirar más allá. La solución estándar en la industria probablemente sea un control en proceso, ejecutado por los operadores y registrado en papel, periódicamente durante la orden; pero no es la mejor respuesta en este caso. Una revisión de Audit Trail nos da una visión completa de la orden, en lugar de las verificaciones puntuales, es menos costosa en recursos y plenamente confiable.
Esa revisión regular del Audit Trail del ejemplo (GMP Annex 11, 9-Audit Trail) debemos implementarla y hacerla útil en todos los casos, pues es la clave final para una plena confianza en los procesos sistematizados.
Las respuestas en estos casos no son únicas y podemos tener varias soluciones igualmente correctas, que se adapten a los recursos disponibles y nuestras formas de trabajo preferidas; pero en todos los casos exigirá un conocimiento profundo de los procesos, de los datos que los soportan y de las soluciones disponibles.
Este ejercicio generará procesos mucho más seguros, que nos permitirán aprovechar las cotas de digitalización cada vez mayores de nuestros equipos y dar una respuesta satisfactoria a los requerimientos de integridad de datos, que en producción va mucho más allá de las clásicas guías. Una vez lo completemos de forma apropiada tendremos, no sólo un cumplimiento integral, sino un importante ahorro en faltas de calidad.
Para todos aquellos que deseen comenzar a evaluar el nivel de cumplimiento de sus equipos respecto a la integridad de datos, aconsejamos centrarse en los siguientes puntos básicos:
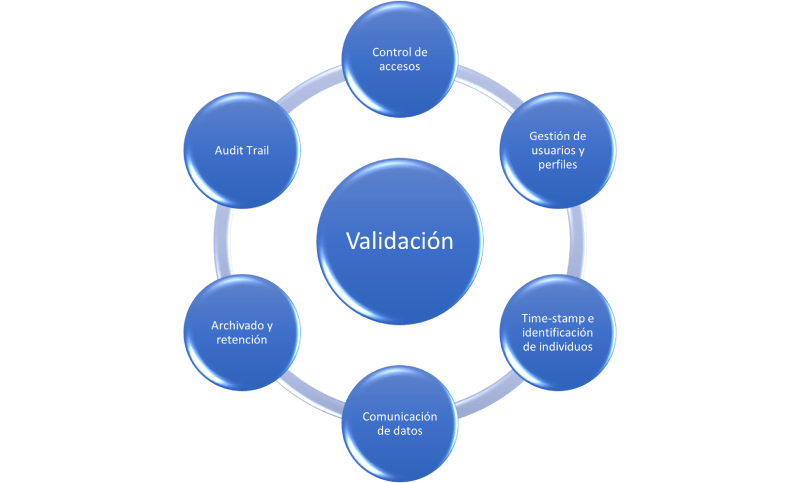
A grandes rasgos hemos conseguido resumir los primeros pasos para afrontar la ingente cantidad de equipos que quedan bajo el alcance de la integridad de datos en la fabricación bajo requisitos GMP. Evidentemente, en cada equipo, en función de sus características unos elementos tendrán preponderancia sobre otros; de forma que en los más sencillos una adecuada gestión de los accesos pueda bastar para asegurar la integridad de datos y el proceso en sí; mientras que en un equipo más complejo, como pueda ser un reactor o cualquiera dotado con recetas, se deberá poner especial cuidado en todas las categorías que hemos definido previamente. La clave siempre estará en los datos que el equipo gestione y su capacidad de informar sobre la calidad del producto, directa o indirectamente.
Aunque no estamos ante un cambio de paradigma, pues los principios son los mismos que aquellos con los que trabajamos desde hace muchos años; sí que estamos ante un cambio de dimensiones y de capacidades, especialmente en la cantidad y calidad de datos de que disponemos y en la capacidad de control sobre los procesos que dichos datos nos permiten. Estas son las primeras consecuencias de esa industria 4.0 de la que tantos años se lleva hablando y que, aquí también, va permeando. En las manos de cada organización y de cada individuo queda aprovechar esta ola como herramienta para modernizar sus procesos, aumentar el control y la estandarización o tratarlos como una carga que añadir al tiempo que se mantienen los antiguos métodos. Los potenciales beneficios son muchos, pero no es menor el reto.
Andres Miguel Arroquia
Qualipharma CSV Leader

