El re-procesamiento o re-utilización de productos de un solo uso, solo podrá llevarse a cabo cumpliendo los requisitos establecidos en el Reglamento UE/2017/745 y si lo permite la Ley Nacional
CLASIFICACIÓN DE PRODUCTOS SANITARIOS
Uno de los primeros pasos que debemos dar, como responsables del marcado CE de nuestros productos, es verificar si estos mantienten su clasificación o, por el contrario, están afectados por los cambios del Reglamento (UE) 2017/745.
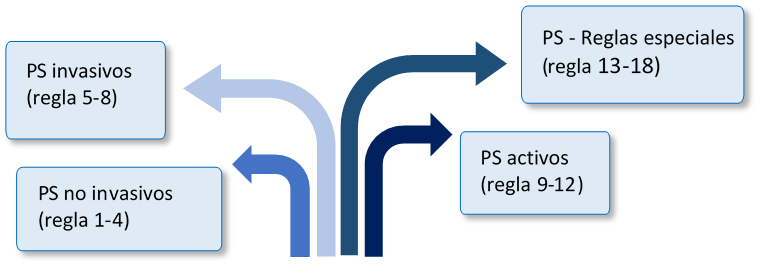
Hasta ahora, de acuerdo a la directiva 93/42/CE, tenenos 18 reglas de clasificación estructuradas de la siguiente manera:
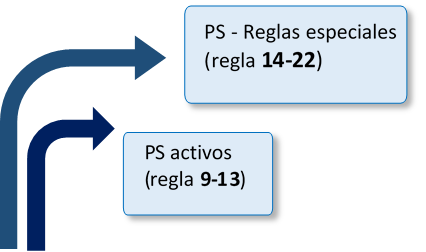
¿Qué más novedades tenemos en la clasificación de los Productos Sanitarios?
El Reglamento incrementa su ámbito de aplicación, incluyendo dentro de su alcance:
- productos dedicados a la limpieza, esterilización o desinfección de productos sanitarios
- productos sin finalidad médica incluidos en el anexo XVI
- productos que llevan incorporado o consisten en un nanomaterial
- los implantables activos y sus accesorios han sido incluidos en la clase III
- los programas informáticos independientes, como las apps, tienen su propia regla de clasificación
Se mantiene la división actual de la Directiva en cuatro clases en función del riesgo, aunque las normas de clasificación han sido modificadas ligeramente por el Reglamento para adaptarse a la experiencia y progreso técnico que ha adquirido a lo largo de los años este sector.

Como todos sabemos, los productos sanitarios de clase I no necesitan la intervención de un Organismo Notificado, excepto aquellos con función de medición o los estériles. En estos casos, el papel de Organismo Notificado es evaluar la exactitud de la medición a la que se refiere el fabricante en las instrucciones de uso o el correcto proceso de esterilización antes de su puesta en el Mercado.
¿Cual es la novedad?
Qué ahora, tal y como se refleja en la tabla anterior, en el grupo de los productos de clase I que necesitan la intervención de un Organismo Notificado, se incluyen los productos de un solo uso susceptibles de ser reprocesados.
 El reprocesado fue uno de los puntos más controvertidos durante la discusión de las diferentes propuestas del Reglamento, decidiendo finalmente la Comisión, que fuera cada Estado Miembro quien decidiera si en su territorio se prohibía, permitía o regulaba dicha situación.
El reprocesado fue uno de los puntos más controvertidos durante la discusión de las diferentes propuestas del Reglamento, decidiendo finalmente la Comisión, que fuera cada Estado Miembro quien decidiera si en su territorio se prohibía, permitía o regulaba dicha situación.
Lo que sí nos deja claro el Reglamento es que:
- las compañías reprocesadoras de productos de un solo uso se considerarán fabricantes de un nuevo medical device y por lo tanto tendrán que asumir las obligaciones que incumben a los fabricantes con arreglo al Reglamento
- el reprocesador, a fin de mantener la trazabilidad, deberá aparecer en el etiquetado
- el fabricante original dejará de aparecer en la etiqueta, aunque seguirá apareciendo en las instrucciones de uso su nombre y dirección
- la documentación que acompaña al producto incluirá el número de ciclos de reprocesamiento ya realizados y las limitaciones en cuanto al número de ciclos
- el reprocesamiento debe garantizar un nivel de seguridad y funcionamiento equivalente al del producto de un solo uso
- tanto el reprocesado como la reutilización de los productos de un solo uso deben ser conformes a las especificaciones comunes aprobadas
- el reprocesamiento se llevará a cabo según especificaciones comunes que detallen los requisitos relativos a:
– La gestión de riesgos
– La validación de los procedimientos de todo el proceso, incluidas las etapas de
limpieza
– El lanzamiento del producto y las pruebas de funcionamiento
– El sistema de gestión de la calidad
– La notificación de incidentes que impliquen a productos que hayan sido reprocesados
IMPORTANTE
Únicamente podrán ser reprocesados los productos de un solo uso que hayan sido introducidos en el mercado con arreglo a lo dispuesto en el presente Reglamento a partir del 26 de mayo de 2020.
¿Qué quiere decir esto? Que los productos de un solo uso que vayan a ser reprocesados, antes de su puesta en el mercado, deberán contar con la aprobación de un Organismo Notificado y obtener la certificación correspondiente de acuerdo con el Reglamento.
¿Cuánto nos queda? 1 año, 1 mes y 18 días.
¿Qué debemos tener en cuenta para saber si estamos listos?
- ¿Tenemos preparada la documentación de nuestro producto?
- ¿Disponemos de un sistema de calidad de acuerdo con la ISO 13485:2016?
- ¿Hemos seleccionado un Organismo Notificado ya certificado con el Reglamento?
Marcado CE: Aspectos Técnicos y Regulatorios para la solicitud
Mostrar su cumplimiento con las actuales directivas y los Reglamentos, de manera que puedan circular libremente dentro de la Unión Europea