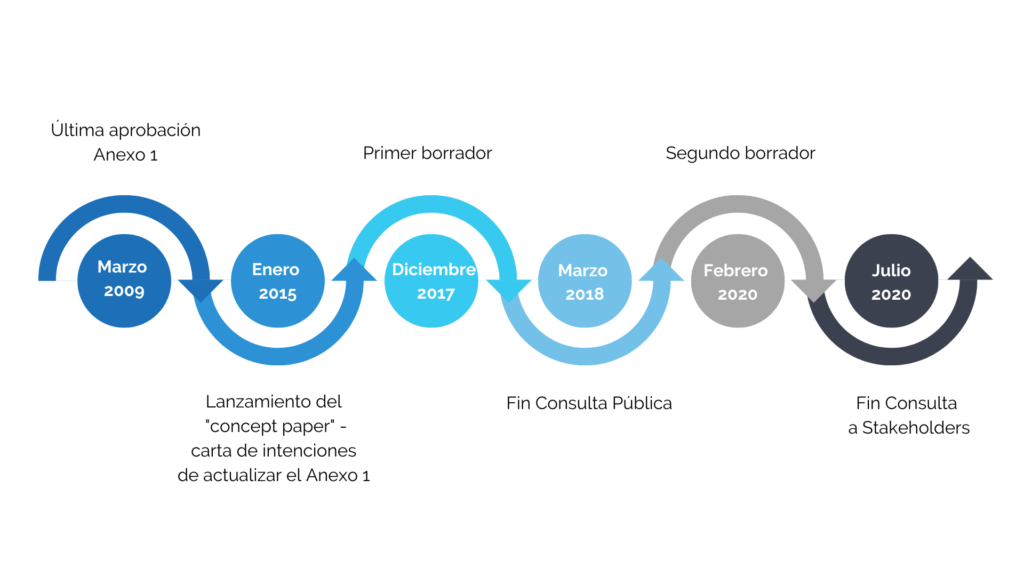
Todo indica que este 2022 es el final del largo recorrido de actualización del anexo 1 (Fabricación de productos estériles) de las cGMP. Este proceso, resumido en la imagen 1, no se ha materializado de forma más ágil por tres razones principales: el traslado de la sede de la Agencia Europea del medicamento de Londres a Ámsterdam en 2019 a causa del brexit, la situación pandémica derivada de la COVID-19 con la necesidad de una situación estable en las normativas para la producción de las diferentes vacunas y, no menos importante, el gran impacto que supone para la industria adaptarse a los cambios que incorpora en relación con la producción de productos estériles.
Imagen 1. Etapas de la actualización del anexo 1
Este proceso de actualización del Anexo 1 ha sido profundo y con afectación en menor o mayor medida a la totalidad de sus apartados. Un ejemplo rápido para representar esto: ¡el paso de tan solo 16 páginas con 127 puntos a 52 páginas con 291 puntos!
Gestionar los cambios
La primera modificación en el nuevo anexo va más allá de aspectos técnicos concretos y es un enfoque diferente en el conjunto del documento, en concreto, la relación del anexo 1 con la gestión de riesgos. El objetivo del anexo sigue siendo definir los requerimientos para “minimizar el riesgo de contaminación microbiológica, por partículas y pirógenos en productos estériles” pero se han introducido tres conceptos nuevos en el alcance y primeros apartados:
- La posibilidad de utilizar los conceptos expuestos en el anexo 1 en áreas de productos no estériles
- Principio de gestión de riesgos de la calidad o Quality Risk Manager (QRM) y sistema de calidad farmacéutico o Pharmaceutical Quality System (PQS)
- La introducción de un mayor nivel de control y estudio de las áreas de productos estériles en forma de una estrategia de control de la contaminación o Contamination Control Strategy (CCS)
El primero de ellos es la práctica habitual extendida por todos los laboratorios en puntos concretos del anexo pero que no se reflejaba en la normativa actual. Por ejemplo, la clasificación de las salas en grados o los límites de control microbiológico durante la monitorización rutinaria. Con esta incorporación, la utilización del anexo 1 como guía en estos casos cobra mayor sentido y queda reflejada.
La incorporación de los términos QRM y PQS era una acción necesaria para la alineación de este anexo con las diferentes actualizaciones de guías del sector sufridas en los últimos años (ICHQ9 o ICHQ10 entre otras). El anexo pasará de una mención casi residual de los conceptos de riesgo y gestión de este a la aplicación de este enfoque durante la implementación de todas las medidas a nivel de procedimientos, equipos, instalaciones, servicios, personal y procesos. Para ejemplificar con números: a lo largo del anexo la palabra riesgo/riesgos aparece 101 veces, en la mayoría de los casos directamente relacionada con su gestión.
Este cambio de estrategia no es nuevo ya que conceptos relacionados con el análisis y gestión de riesgos (análisis modal de fallos y efectos, medidas de mitigación, riesgo residual…) están ampliamente instaurados en los laboratorios farmacéuticos. Esto es consecuencia directa del hecho que las diferentes normativas o guías al respecto han sido actualizadas a lo largo de los años con periodicidad bastante superior al anexo 1. Por tanto, la afectación dentro del laboratorio es, en primera instancia, de revisión de esta gestión de riesgo en todos los aspectos reflejados en el anexo 1.
¿Pero cómo podemos realizar esta revisión? Esta pregunta está directamente relacionada con el nuevo elemento que se presenta en el borrador: la estrategia de control de la contaminación o Contamination Control Strategy (CCS).
La CCS se presenta como un documento que debe definir todos los puntos críticos del proceso, los controles realizados, su efectividad y las medidas de monitorización para controlar todos los riesgos asociados con contaminación del producto. Por tanto, nos permitirá estudiar dos cosas: si estamos implementando todas las medidas actualizadas en el nuevo anexo 1 y si la gestión de riesgos realizada sobre estas es correcta.
Siguiendo la hoja de ruta
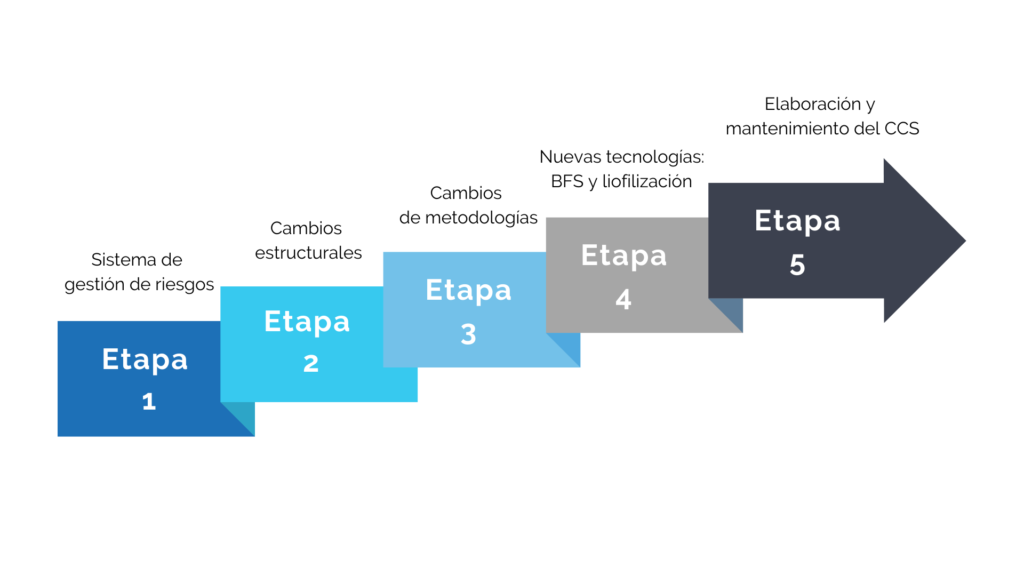
Después de esta introducción a los cambios generales del anexo 1 y a la importancia del sistema de gestión de riesgos, debemos estudiar paso a paso las modificaciones técnicas establecidas en la actualización. Haciendo esto, al final de esta ruta de mejora y actualización seremos capaces de establecer una CCS que nos permita asegurar que nuestro sistema de calidad farmacéutico es capaz de cumplir ese objetivo inicial que definía el anexo 1: “minimizar el riesgo de contaminación microbiológica, por partículas y pirógenos en productos estériles”.
Desde Qualipharma os proponemos hacer este viaje a través de una serie de 5 artículos para analizar las diferentes partes del nuevo anexo 1 e identificar los cambios producidos. Al llegar al destino, podremos finalizar con los conocimientos y herramientas necesarias para la elaboración de una CCS que se adapte a nuestro laboratorio y a la actualización de la normativa.
Imagen 2. Hoja de ruta para prepararse para la actualización del Anexo 1


3 comentarios
Ana María Fallas Quesada
Muy clara la explicación
Gracias
teo obispo
Muy interesante la recopilación de articulos sobre el «road map» del anexo 1.
Muchas gracias
RAMON RESTREPOI
Siempre es importnate estar actualizados con las tendencias y actualizaciones de las normativas del sector